2.1.1แบบจำลองอะตอมของดอลตัน
John Dalton
ปี พ.ศ. 2346 (ค.ศ. 1802) จอห์น ดอลตัน ได้เสนอทฤษฎีอะตอม ซึ่งมีสาระสำคัญดังนี้
- ธาตุประกอบด้วยอนุภาคเล็กๆ อนุภาคเหล่านี้เรียกว่า อะตอม แบ่งแยกและทำให้สูญหายไม่ได้
- อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกัน
- สารประกอบเกิดจากอะตอมของธาตุมากกว่าหนึ่งชนิดทำปฏิกิริยาเคมีกันในอัตราส่วนที่เป็นเลขลงตัวน้อยๆ
2.1.2 แบบจำลองอะตอมของทอมสัน
J.J. Thomson
ปี พ.ศ. 2440 (ค.ศ. 1897) เซอร์เจ.เจ. ทอมสัน นักวิทยาศาสตร์ชาวอังกฤษทำการทดลองโดยให้รังสีแคโทดเคลื่อนที่ผ่านสนามไฟฟ้าที่ตั้งฉากกับสนามแม่เหล็ก จากข้อมูลการทดลองร่วมกับทฤษฎีสนามแม่เหล็กไฟฟ้าทำให้ทอมสันนำมาใช้คำนวณอัตราส่วนของประจุต่อมวล (e/m) ของรังสีแคโทดได้ การค้นพบอิเล็กตรอนทำให้ทอมสันสรุปได้ว่า อะตอมทุกชนิดมีอิเล็กตรอนเป็นองค์ประกอบซึ่งลบล้างแนวคิดที่ว่าอะตอมแบ่งแยกไม่ได้ และเนื่องจากสารต่างๆที่อยู่ในสภาวะปกติจะเป็นกลางทางไฟฟ้า จึงสรุปได้ว่า อะตอมเป็นกลางทางไฟฟ้า ทำให้เขาเสนอแบบจำลองว่า อะตอมเป็นรูปทรงกลมประกอบด้วยเนื้ออะตอมซึ่งมีประจุบวกและอิเล็กตรอนซึ่งมีประจุลบกระจายอยู่ทั่วไป และถ้าอยู่ในสภาพที่เป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกกับประจุลบเท่ากัน
2.1.3 แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
Ernest Rutherford
ปี พ.ศ. 2454 (ค.ศ. 1911) เออร์เนสต์ รัทเทอร์ฟอร์ดและฮันส์ ไกเกอร์ ได้พิสูจน์แบบจำลองอะตอมของทอมสันโดยการยิงอนุภาคแอลฟาไปยังแผ่นทองคำบางๆ รัทเทอร์ฟอร์ดอธิบายลักษณะภายในอะตอมว่า การที่รังสีแอลฟาส่วนใหญ่ผ่านแผ่นทองคำไปได้ แสดงว่าภายในอะตอมต้องมีที่ว่างอยู่เป็นบริเวณกว้าง การที่รังสีแอลฟาบางอนุภาคเบี่ยงเบนหรือสะท้อนกลับมาบริเวณด้านหน้าฉากเรืองแสง แสดงว่าภายในอะตอมน่าจะมีกลุ่มอนุภาคที่มีขนาดเล็กมาก มีมวลสูงมากกว่ารังสีแอลฟาและมีประจุบวก เขาจึงเสนอแบบจำลองใหม่ว่า อะตอมประกอบด้วยนิวเคลียสที่มีขนาดเล็กมากอยู่ภายในและมีประจุไฟฟ้าเป็นบวก โดยมีอิเล็กตรอนเคลื่อนที่อยู่รอบๆ
2.1.4 แบบจำลองอะตอมของโบร์
Niels Bohr
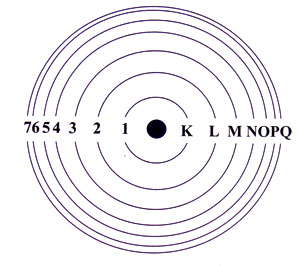
จากความรู้เรื่องการเปลี่ยนแปลงระดับพลังงานของอิเล็กตรอนและการเกิดสเปกตรัม ช่วยให้นีลส์ โบร์ สร้างแบบจำลองอะตอมเพื่อใช้อธิบายพฤติกรรมของอิเล็กตรอนในอะตอมได้ โดยกล่าวว่า อิเล็กตรอนจะเคลื่อนที่รอบนิวเคลียสเป็นวงคล้ายกับวงโคจรของดาวเคราะห์รอบดวงอาทิตย์ แต่ละวงจะมีระดับพลังงานเฉพาะตัว ระดับพลังงานของอิเล็กตรอนที่อยู่ใกล้นิวเคลียสที่สุดเรียกว่าระดับ K และระดับพลังงานที่อยู่ถัดออกมาเรียกเป็น L M N ... ตามลำดับ
มีการใช้ตัวเลขแสดงถึงระดับพลังงานของอิเล็กตรอน คือ n=1 หมายถึงระดับพลังงาน 1 ซึ่งอยู่ใกล้กับนิวเคลียสที่สุด และจะสูงขึ้นไปตามลำดับ
2.1.5 แบบจำลองอะตอมแบบกลุ่มหมอก
นักวิทยาศาสตร์พบว่ามีโอกาสที่จะพบอิเล็กตรอนรอบนิวเคลียสบางบริเวณเท่านั้น ทำให้สร้างมโนภาพได้ว่าอะตอมประกอบด้วยกลุ่มหมอกอิเล็กตรอนรอบนิวเคลียส บริเวณที่กลุ่มหมอกหนาแปลว่ามีโอกาสพบอิเล็กตรอนได้มากกว่าบริเวณที่กลุ่มหมอกจาง









ไม่มีความคิดเห็น:
แสดงความคิดเห็น